MIARECZKOWANIE KOMPLEKSOMETRYCZNE
Pomimo, że podczas miareczkowania przebiegają inne reakcje, można doszukać się bliskich analogii ze zwykłym miareczkowaniem alkacymetrycznym.
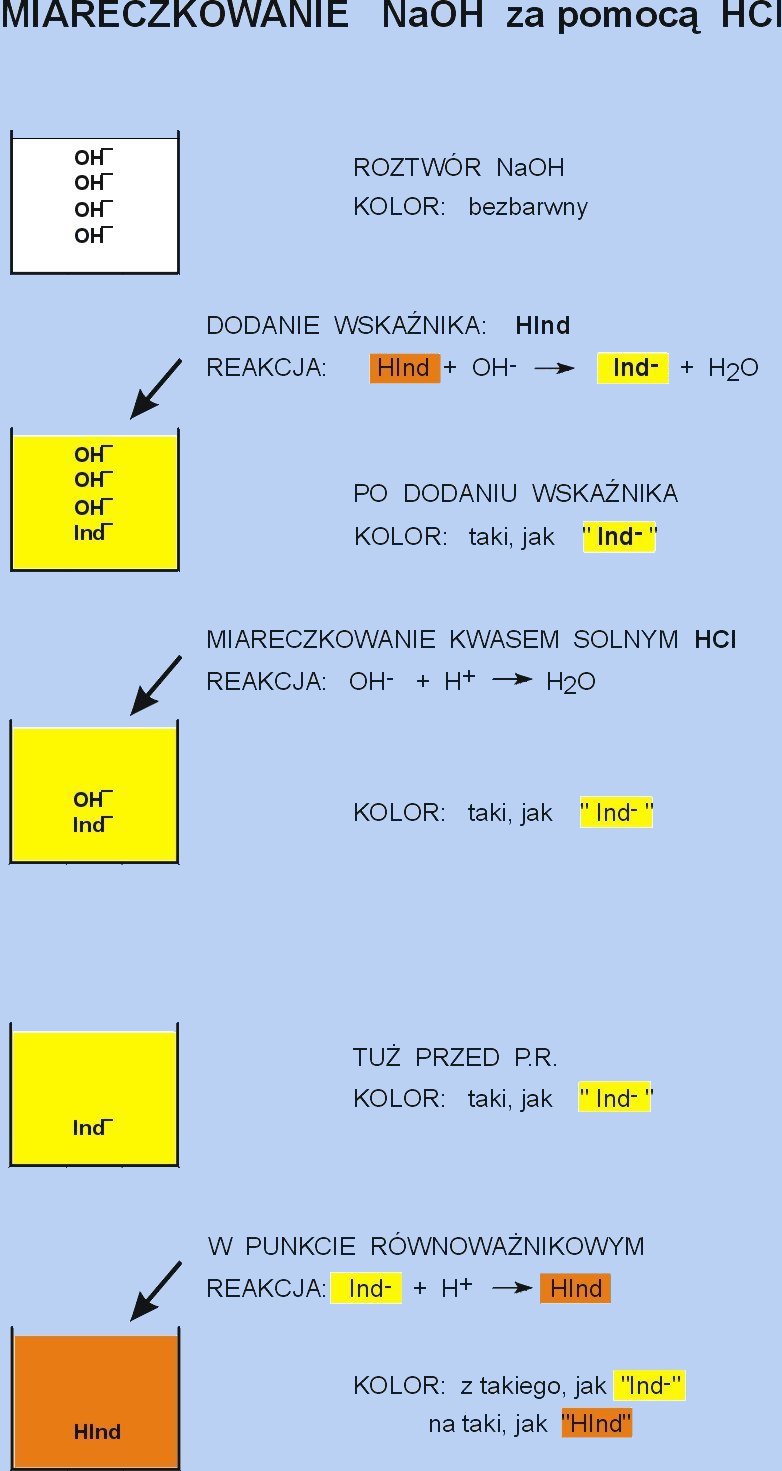
Jeśli do roztworu (bezbarwnego) NaOH dodać wskaźnika HInd, to nastąpi reakcja z zasadą, a wskaźnik zamieni się w sól, której aniony Ind− zabarwiają roztwór na charakterystyczny (tu: żółty) kolor. Podczas miareczkowania kwasem solnym mieszaniny NaOH + Ind− , jako pierwsza reaguje mocna zasada: OH− . Do momentu tuż przed P.R. zabarwienie pozostaje niezmienione. Ostatnia kropla HCl powoduje przekształcenie żółtych anionów Ind− w wyjściowy wskaźnik w formie kwasowej. Związana jest z tym zmiana barwy na taką, jaka mają te właśnie niezdysocjowane cząsteczki HInd (tu: pomarańczowe). Aby ta reakcja mogła zajść, wskaźnik musi być słabym elektrolitem, w przeciwnym wypadku, niezależnie od środowiska, pozostawałby stale w postaci barwnych anionów.
Wskaźnik alkacymetryczny jest więc sam kwasem/zasadą Bronsteda, jego niezdysocjowane cząsteczki mają inną barwę, niż zdysocjowane jony, jest słabym elektrolitem. Zmiana barwy wskaźnika po dodaniu kwasu lub zasady spowodowana jest zakłóceniem procesu równowagi dysocjacji wskaźnika przez dodany odczynnik. Kierunek zakłócenia opisuje Prawo Równowagi Chemicznej.

TERAZ: KOMPLEKSOMETRIA...
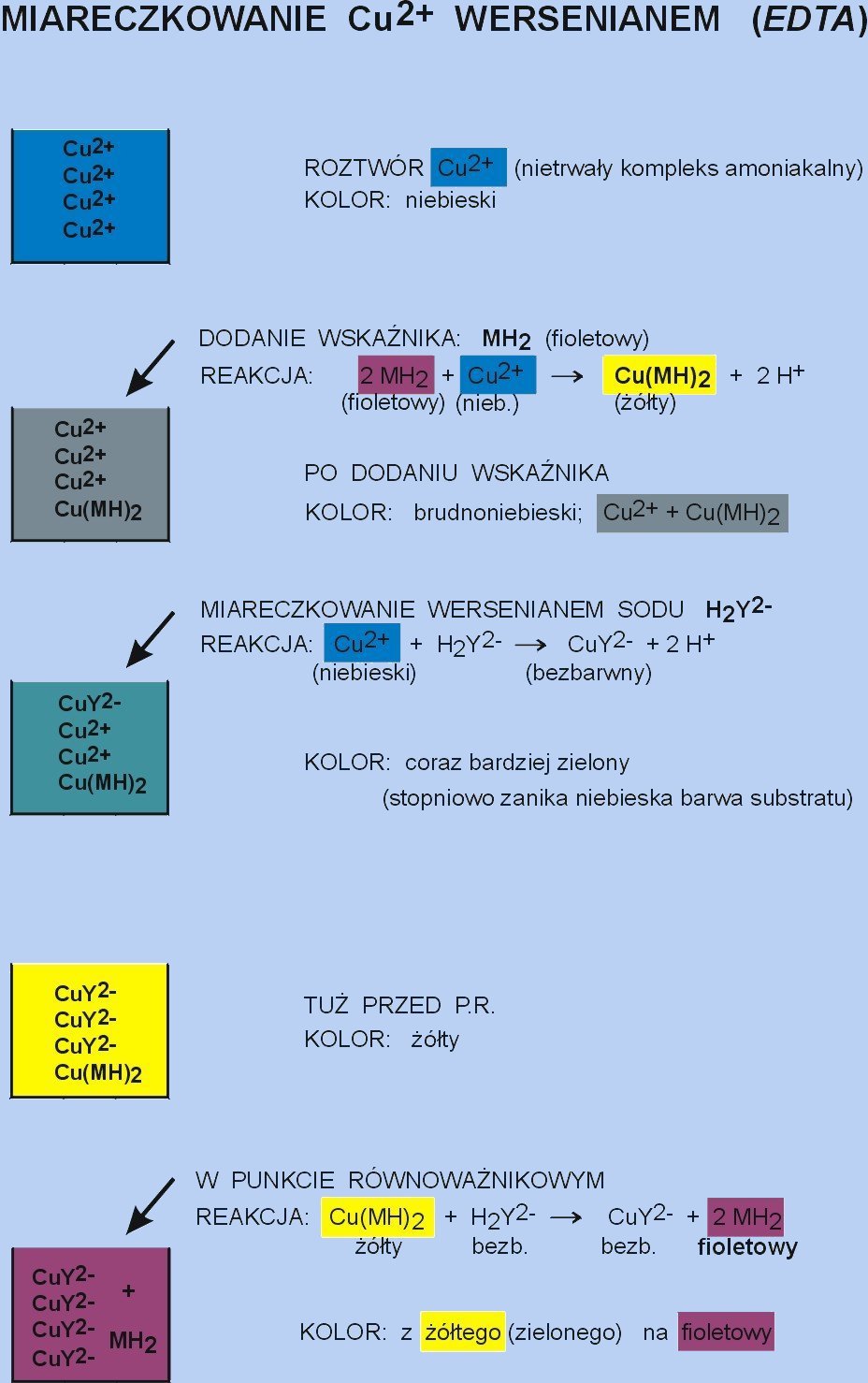
Metalowskaźnik MH2 ma określoną barwę (tu: fioletową); reaguje on z niebieskimi kationami miedzi, dając kompleks Cu(MH)2 o barwie zółtej. Mieszanina Cu2+ oraz kompleksu Cu(MH)2 jest więc barwy brudnoniebieskiej. Podczas miareczkowania tej mieszaniny za pomocą mianowanego roztworu wersenianu sodu H2Y2− , jako pierwsze reagują wolne jony miedzi: Cu2+ + H2Y2− → CuY2− + 2 H+ , dając niemal bezbarwny kompleks: miedź-wersenian. Stopniowo ubywa niebieskich jonów miedzi, barwa zmienia się więc stopniowo na zieloną, a następnie, tuż przed P.R. - na niemal żółtą (barwa kompleksu: miedź-wskaźnik). Ostatnia kropla wersenianu powoduje zamianę żółtego kompleksu miedź-wskaźnik, na trwalszy bezbarwny kompleks: miedź-wersenian, oraz wyparcie wolnego wskaźnika o barwie fioletowej.
Metalowskaźnik jest więc ligandem w stosunku do kationów metalu, w postaci wolnej ma on inną barwę, niż w postaci kompleksu z kationami metalu. Daje on mniej trwały kompleks z kationami metalu, niż dzieje się to z wersenianem. Zmiana barwy wskaźnika jest spowodowana różnicą trwałości i utworzeniem bardziej trwałego kompleksu z wersenianem, i wydzieleniem wolnego metalowskaźnika.
Tomasz Pluciński
tomek@chem.univ.gda.pl
F strona główna