KOROZJA ELEKTROCHEMICZNA ŻELAZA W ODCZYNNIKU FERROKSYLOWYM
**ostatnia aktualizacja: 17.09.2006, więcej zdjęć ukaże się niebawem**
Korozja żelaza... Wstrętne rdzawe zacieki na lśniącym lakierze naszego wypieszczonego samochodu, zapieczone głupie śruby, których odkręcanie doprowadza do furii, kosztowna wymiana karoserii u blacharza, wypadek spowodowany pęknięciem skorodowanej części. A z drugiej strony skomplikowany mechanizm zarówno chemiczny jak i i elektryczny. Oj, nie lubimy korozji zarówno na codzień, jak i nie lubią tego tematu w szkole uczniowie i nauczyciele. A przecież korozja elektrochemiczna żelaza jest jednym z najwdzięczniejszych tematów dydaktycznych. Można ją ilustrować wyjątkowo sugestywnymi nieskomplikowanymi kolorowymi doświadczeniami oraz zaskakującymi paradoksami.
Po zanurzeniu kawałka żelaza (stali) do roztworu, zachodzi samorzutna reakcja przechodzenia jonów żelaza do roztworu, a uwolnione w tym procesie elektrony pozostają na powierzchni metalu i nadają mu potencjał ujemny.
Fe ® Fe2+ + 2e–
Proces ten zachodzi w bardzo nieznacznym, niemierzalnym niemal stopniu, bo powstający ujemny potencjał znacznie utrudnia odrywanie dalszych, kolejnych dodatnio naładowanych kationów żelaza. Aby reakcja mogła zachodzić w znacznym stopniu, konieczny jest udział substancji, która może skonsumować nadmiar elektronów. Substancją tą jest oczywiście jakikolwiek utleniacz (definicja utleniacza: substancja mogąca przyłączać elektrony). W typowych procesach korozji elektrochemicznej jest nią gazowy tlen rozpuszczony w roztworze:
O2 + 2 H2O + 4e– ® 4 OH–
lub (w jego nieobecności) - po prostu woda:
2 H2O + 2e– ® 2 OH– + H2
Tak więc korozja polega na jednoczesnym zachodzeniu dwóch procesów:
· utlenienia żelaza: powstawania jonów żelazawych (potem ulegają one dalszemu, nieelektrochemicznemu utlenieniu do wyższych uwodnionych tlenków żelaza - rdzy lub magnetytu)
· redukcji tlenu: powstaje w wyniku tego zalkalizowanie roztworu
Mógłby w tym miejscu ktoś spytać: dlaczego w podobny sposób nie koroduje srebro lub miedź?
Bo potencjał (gęstość) uwolnionych elektronów, jakiego nabywa mało aktywny metal, jakim jest np. miedź, jest zbyt mały, aby mogła zachodzić konsumpcja tych elektronów przez słaby utleniacz, jakim jest tlen lub woda. W przyjętej umownie skali potencjałów w stosunku do układu wodór/jony wodorowe, potencjał ten jest wręcz dodatni (w stosunku do umownego wzorca wodorowego)
Najczęściej procesy te zachodzą co prawda jednocześnie, lecz mogą przebiegać w różnych, czasem oddalonych od siebie miejscach. Właściwy proces niszczenia korozyjnego jest procesem utlenienia, a miejsce w którym on zachodzi nazywa się obszarem anodowym (taka jest zresztą definicja anody w elektrochemii). Towarzyszy mu równoczesny proces redukcji (nie powodujący bezpośrednio uszkodzeń korozyjnych) - w obszarach katodowych.
Do śledzenia przebiegu korozji można zastosować odczynnik, który powinien umożliwiać obserwację powstawania jonów żelazawych oraz anionów wodorotlenkowych (czyli po prostu alkaliczności). Składnikami tego odczynnika są: cyjanożelazian (dawniej: czerwony żelazicyjanek) K3Fe(CN)6, oraz fenoloftaleina. Kationy żelazawe tworzą niebieskozieloną plamę Błękitu Pruskiego, natomiast zasadowe aniony wodorotlenkowe dają czerwoną plamę z fenoloftaleiną. Aby zapobiec rozmywaniu powstających plam, odczynnik stosuje się w postaci galarety żelatynowej lub agarowej (są dane, że Błękit Pruski jest identyczny z Błękitem Turnbulla).
Agar daje lepsze wyniki niż żelatyna, bo krzepnie po ochłodzeniu bardzo raptownie i daje o wiele mniej rozmyte barwne plamy produktów korozji. Korozję przyspiesza dodatek neutralnej substancji jonowej, np. NaCl.
odczynnik ferroksylowy
Do 100 ml gorącego 1,5-procentowego roztworu Agaru dodać kilka kryształków (ok. 50 mg) K3Fe(CN)6 oraz nieco alkoholowego roztworu fenoloftaleiny, i ok. 2 g soli kuchennej. Po ochłodzeniu roztworu do ok. 40 stopni, dodaje się kroplami bardzo rozcieńczony roztwór NaOH, do powstania pierwszych śladów słabego zabarwienia różowego. Odczynnik stosuje się w postaci płynnego ciepłego roztworu, którym można np. malować pędzlem fragmenty testowanych metalowych konstrukcji technicznych.
miejsca anodowe, miejsca katodowe...
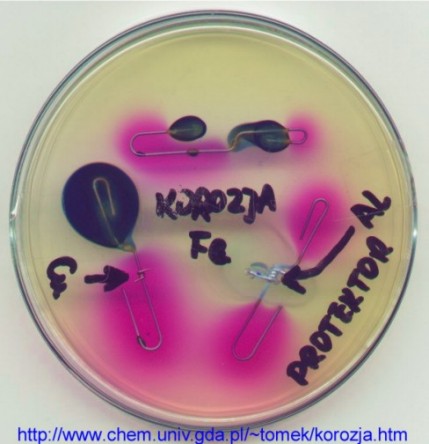
Przygotować trzy spinacze biurowe (najzwyklejsze stalowe, nie niklowane lub powlekane). Pierwszy należy rozgiąć, drugi rozłamać przez kilkukrotne zginanie, trzeci rozklepać młotkiem w połowie prostego odcinka. Na płytkę Petriego ułożoną na zimnym (np. metalowym) podłożu nalać warstwę płynnego ciepłego odczynnika ferroksylowego, o grubości ok. 1 cm. Po kilkunastu sekundach można zaobserwować pierwsze oznaki żelowania w postaci „marmurkowej” struktury na powierzchni roztworu. W tym momencie należy szybko do roztworu zanurzyć metalowe eksponaty, i pozostawić całość do całkowitego skrzepnięcia. Pierwsze ślady korozji można zaobserwować już po 2-3 minutach. Są to małe, ostro zarysowane ciemno zabarwione zielonogranatowe plamy Błękitu Pruskiego - w miejscach anodowych (korozji). Oraz bardziej rozmyte różowe plamy w miejscach katodowych; plamy te są bardziej rozmyte, gdyż dyfuzja ruchliwych anionów wodorotlenkowych jest o wiele szybsza niż dyfuzja koloidalnego osadu wielkocząsteczkowego Błękitu Pruskiego.

Wnioski z przebiegu doświadczenia są następujące: korozja żelaza jest procesem złożonym z dwóch równoczesnych reakcji elektrochemicznych: utlenienia i redukcji. Reakcje te zachodzą co prawda równocześnie, ale w różnych miejscach. To rozdzielenie miejsc utlenienia i redukcji jest jedną z najbardziej charakterystycznych cech reakcji elektrochemicznych! W przypadku jednorodnego materiałowo przedmiotu stalowego zanurzonego w jednorodnym roztworze, zróżnicowanie spowodowane może być przez różny stan obróbki mechanicznej w przeszłości. Z reguły miejscami anodowymi (miejscami właściwej korozji), są miejsca poddane kiedyś naprężeniom - stresowi mechanicznemu. Są to miejsca cięcia, silnego zgięcia lub uderzenia. Pozostałe nienaprężone fragmenty są z reguły miejscami katodowymi. Warto więc pamiętać, że miejsca karoserii samochodowej zgięte po raz pierwszy w wypadku, a po raz drugi podczas „klepania” w warsztacie, będą także „pamiętać” owe brutalne potraktowanie - i będą w przyszłości szczególnie intensywnie korodować. Warto więc ich stan kontrolować szczególnie uważnie...
gdy tlenu zabraknie: pęcherze pod lakierem
Czasem na lakierze karoserii samochodu powstają miękkie pęcherze, które poddają się naciskowi palca. Są to miejsca katodowej redukcji w warunkach beztlenowych. Powstają one często w miejscach odległych od właściwego ogniska korozyjnego. Niedokładności naniesienia lakieru powodują, że dostęp tlenu jest skutecznie ograniczony, natomiast pod lakier może dostawać się woda deszczowa (siły kapilarne). W tych warunkach produktem redukcji jest gazowy wodór, który powoduje powstanie pęcherza. Alkaliczne środowisko powoduje jednocześnie zmiękczenie lakieru. Proszę porównać zapis trzeciego równania na początku opisu.
powłoki anodowe
Powtórzyć doświadczenie z dwoma spinaczami: pierwszy pozostawić bez zmian - dla kontroli, a drugi pomiedziować przez zanurzenie w kilkuprocentowym roztworze CuSO4. Można też użyć ozdobnego spinacza niklowanego, który nadpiłować pilnikiem w dwóch miejscach. Przedmioty pokryte warstwą metalu bardziej szlachetnego od żelaza, są zabezpieczone przed korozją - pod warunkiem, że pokrycie jest bardzo dokładne, bez pęknięć i szczelin. W takim bowiem przypadku powstaje mikro (lub makro) ogniwo, w którym anodą jest żelazo, a katodą metal bardziej szlachetny. W takim ogniwie następuje gwałtowne przyspieszenie korozji. Niszczenie korozyjne żelaza jest szybsze, niż gdyby w ogóle nie stosować żadnego pokrycia. Miedziowanie bezprądowe żelaza przebiega bardzo gwałtownie, i powoduje osadzenie gąbczastej powłoki miedzi pozostawiając wiele odsłoniętych niezmienionych fragmentów powierzchni stali. Powoduje to późniejszą szybką korozję z udziałem mikroogniw.
protektory katodowe
Powtórzyć doświadczenie z trzema spinaczami: pierwszy pozostawić do kontroli bez zmiany, drugi owinąć kilkoma zwojami miękkiego oczyszczonego drutu aluminiowego, a trzeci owinąć kawałkiem oczyszczonej wstążki magnezowej. Bardzo szybko wokół spinacza powstaje różowa plama; przedmiot stalowy staje się katodą ogniwa (brak jakichkolwiek oznak korozji stali, nawet w miejscach stresu mechanicznego). Anodą jest reaktywny metal: glin lub magnez. Reakcją anodową jest proces powstawania jonów protektora:
Al ® Al3+ + 3e–
a następnie ew. strącania osadu wodorotlenku:
Al3+ + 3 H2O ® Al(OH)3 + 3 H+
Produktów tych reakcji anodowych nie da się zaobserwować przy użyciu odczynnika ferroksylowego. Jedynie w przypadku zastosowania cynku jako protektora, powstaje żółtawy osad żelazicyjanku cynku.
Mechanizm działania protektora katodowego polega na tym, że aktywny metal protektora koroduje znacznie energiczniej niż żelazo. Uwalniane elektrony gromadzą się na powierzchni przedmiotu (protektor jest w kontakcie elektrycznym z przedmiotem chronionym), nadając mu znaczny potencjał ujemny. Ujemny potencjał jak już wspomniano, skutecznie utrudnia powstawanie dodatnio naładowanych kationów żelaza (produktu korozji żelaza). Obiekt chroniony jest więc katodą ogniwa korozyjnego (stąd nazwa tej metody).
Ochrona katodowa w praktyce polega na stosowaniu np. elementów stalowych pocynkowanych hutniczo (blacha, drut). Charakterystyczne, że pokrycie warstwą cynku nie musi być ani szczelne, ani jednolite. Dopóki w kontakcie z przedmiotem pozostaje chociaż trochę cynku, chroni on skutecznie cały obiekt. W przypadku konstrukcji wielkogabarytowych (most, rurociąg, kadłub statku) wystarczy przymocowanie do niego elementu ochronnego, którym są najczęściej stopy glinu, cynku i magnezu. Protektory takie szybko korodują („anody ofiarne”, czyli przeznaczone „na pożarcie”), i wymagają częstej kontroli skuteczności kontaktu elektrycznego z masą elementu chronionego - oraz wymiany skorodowanego protektora.
Przyspieszoną korozję metalicznego magnezu w kontakcie z żelazem wykorzystuje się w jednorazowych F ogrzewaczach elektrochemicznych FRH stosowanych w wojsku (do podgrzewania potraw w warunkach polowych), i w turystyce.
ochrona prądowa
Nadanie obiektowi stalowemu potencjału ujemnego hamuje korozję. Źródłem elektronów może być kontakt z reaktywnym metalem - w przypadku protektorów katodowych. Jeszcze prostszym sposobem nadania potencjału ujemnego może być podłączenie obiektu do bieguna ujemnego baterii... Baterię można sobie wyobrazić jako pompę wsysającą elektrony (anoda +) , a jednocześnie tłoczącą elektrony (katoda –).
Do demonstracji przygotować odczynnik ferroksylowy w postaci płynnej (bez agaru); zamiast fenoloftaleiny można użyć błękitu tymolowego. Ten trójbarwny wskaźnik pozwala na śledzenie zarówno zalkalizowania, jak i zakwaszenia roztworu.
Dwa spinacze podłączone do biegunów baterii 3 V zanurzyć jednocześnie do odczynnika ferroksylowego. Obiekt podłączony do bieguna „–” (katody baterii) nie ulega korozji (zabarwienie różowe fenoloftaleiny). Gwałtownie koroduje natomiast obiekt połączony z anodą baterii. Metoda stosowana jest do ochrony korozyjnej statków. Kadłub połączony jest z katodą źródła prądu stałego, natomiast anoda sporządzona jest (dla wygody obsługi) nie ze stali, a z materiału bardzo odpornego na utlenianie: grafitu, wolframu lub tytanu i jest ona holowana w wodzie za statkiem. Procesowi utleniania ulega woda. W praktyce taki system antykorozyjny jest dość skomplikowany. Do ochrony trzeba stosować podłączenie kadłuba w wielu miejscach, i w sposób ciągły kontrolować wielkość prądu ochronnego, oraz potencjał w różnych miejscach obiektu chronionego.
Do roztworu odczynnika zanurzyć zestaw elektrod: grafitową anodę (+) oraz stalową (spinacz) katodę (–). Nie powstaje niebieska plama produktów korozji. Aby uwidocznić produkty utlenienia, wyjątkowo tu użyto zamiast fenoloftaleiny, błękitu tymolowego. Otoczenie anody barwi się na czerwono (powstaje kwas).
Podobny problem mają posiadacze samochodów. Jeden biegun akumulatora połączony jest na stałe z „masą” karoserii. Nawet po wyłączeniu stacyjki, pozostaje połączenie akumulatora (światła awaryjne, alarm). Który z zacisków powinien być połączony z masą, jeśli ma to sprzyjać ochronie antykorozyjnej?
paradoks tlenowy korozji
Sumarycznie korozja żelaza, to reakcja utleniania żelaza tlenem (lub wodą). Wydawałoby się, że im większe stężenie utleniacza, tym gwałtowniejsza korozja...
Na dokładnie oczyszczoną papierem ściernym blachę stalową nanieść większą porcję ciepłego odczynnika ferroksylowego w taki sposób, aby zakrzepnięty roztwór utworzył wypukły kształt. Po kilku minutach widać oznaki korozji: wnętrze kropli barwi się na niebiesko, a brzegi na czerwono. Jest to wynik zaskakujący: najsilniej nasycone tlenem są brzegi kropli (jest tam najcieńsza warstwa roztworu), a w miejscach tych korozja w ogóle nie zachodzi! Natomiast najintensywniej korodują miejsca najsłabiej natlenione w środku kropli.
Miejsca o największym stężeniu utleniacza są najbardziej podatne na jego redukcję. Innym prawdopodobnym powodem jest tworzenie się w tych miejscach pasywującej szczelnej ochronnej warstwy magnetytu Fe3O4. Inny powód, to fakt, że proces redukcji następuje najłatwiej w miejscu o największym stężeniu utleniacza.
Efektowny pokaz paradoksu tlenowego korozji można zademonstrować jeszcze inaczej. Przygotować oczyszczoną z lakieru papierem ściernym, żyletkę, którą opasać wzdłuż nieco szerszą gumką-recepturką. Nie powinna ona być zbyt mocno naciągnięta, bo spowoduje wygięcie żyletki; istotne jest tu dość dokładne przyleganie gumki do metalu. Zestaw taki zanurzyć w słoiku napełnionym kilkuprocentowym roztworem soli, i pozostawić na kilkanaście dni. Słoik powinien być uchylony aby umożliwić dostęp powietrza, a parującą wodę trzeba uzupełniać. Po kilkunastu dniach intensywna korozja pod paskiem gumki powoduje pęknięcie żyletki. Tak więc gumka przecięła żyletkę... Jeszcze inaczej i szybciej można pokazać ten paradoks przez naciągnięcie mokrego pierścienia gumowego odciętego z gumki zakraplacza aptecznego na gruby, dokładnie oczyszczony gwóźdź stalowy - i zanurzenie całości na kilkanaście minut do roztworu soli. Na fragmencie powierzchni osłoniętej gumką szybko powstaje brązowy nalot rdzy.
Paradoks tlenowy korozji jest powodem kłopotliwego zapiekania się nakrętek na śrubach. Najintensywniej korodują miejsca o utrudnionym dostępie tlenu - a więc wewnątrz połączenia gwintowego. Powstające objętościowe gąbczaste produkty korozji powodują scementowanie i zapieczenie gwintu.
inhibitory korozji
Po zademonstrowaniu paradoksu tlenowego korozji nie powinno być zaskoczeniem, że skutecznymi inhibitorami korozji są niektóre utleniacze! Rozgięty spinacz zanurzyć do odczynnika ferroksylowego z dodatkiem 2% azotynu sodu. Nie obserwujemy oznak korozji. Prawdopodobnie następuje powierzchniowe utlenienie do cienkiej izolującej szczelnej warstwy magnetytu. Do zapobiegania korozji instalacji CO stosowany bywa dodatek dwuchromianów. Również woda z pierwotnego obiegu wody z elektrociepłowni zawiera szkodliwe inhibitory. Ciepła woda w naszych mieszkaniach pochodzi z wymienników ciepła i w zasadzie nie powinna być skażona tymi dodatkami. W wypadku uszkodzenia wymiennika ciepła mogą się jednak one pojawić. Na wszelki wypadek nie powinno się więc do celów spożywczych stosować ciepłej wody z kranu...
Innym inhibitorem jest domieszka np. niewielkich ilości arsenu w stali. Również stosunkowo nieznaczny dodatek innych metali zmienia zasadniczo właściwości stopu. Stal nierdzewna jest nie tylko odporna na korozję, ale niemal nie ma właściwości magnetycznych. Skutecznymi inhibitorami reakcji żelaza z kwasami, jest urotropina, kleje żelatynowe i fosforany. Są one stosowane w silnie kwaśnych odrdzewiaczach fosforanowych. Silnie kwaśny roztwór skutecznie roztwarza osady tlenków, a niemal całkowicie blokuje reakcję wydzielania wodoru.
chlorki i inne sole
Pracy ogniwa korozyjnego (jak zresztą każdego ogniwa) towarzyszy ruch jonów niezbędny do zachowania warunku elektroneutralności. Obecność jonów (soli) w roztworze znacznie przyspiesza korozję. Stąd znane wszystkim skutki posypywania solą ulic zimą. Jony chlorkowe dodatkowo potęgują korozję, ponieważ tworzą z powstającymi jonami metali kompleksy. W przypadku korozji chlorkowej żelaza (i miedzi) jej tempo jest szczególnie wielkie z powodu wieloetapowego mechanizmu, w którym bierze udział metal i jony metalu na dwóch różnych stopniach utlenienia. Sole są stosowane z powodu ich wpływu na obniżenie temperatury krzepnięcia roztworu - zimą (a jednocześnie podwyższenia temperatury wrzenia np. płynu chłodniczego). Fakt dysocjacji powoduje, że są one wielokrotnie skuteczniejsze niż dodatek substancji niejonowych o tym samym stężeniu molowym. Wszędzie jednak tam, gdzie korozja jest szczególnie nasilona, powinno się stosować dodatek substancji niejonowych (pożądana jest oczywiście możliwie niska masa cząsteczkowa dodatku). Do chłodnic stosuje się dodatek glikolu, a do spryskiwaczy szyb lub szamponów samochodowych dodatek metanolu lub "izopropanolu" (poprawniej: propanolu-2), lub mocznika.
Posypywanie ulic solą powoduje silne zniszczenie okolicznych drzew, a używanie piasku zanieczyszcza przewody kanalizacyjne. W moim mieście dziennikarze wszczęli kiedyś odpowiednią akcję protestacyjną. Władze miasta odpowiedziały, że zmieniają stosowane środki, i zamiast piasku i soli będą odtąd stosowane materiały zszorstkowywujące z dodatkiem chlorku sodu (sic!).
nieuchronna przyczyna
Pierwotną przyczyną zachodzenia korozji elektrochemicznej, jest różnica potencjałów redoks żelaza i natlenionego roztworu. Ponieważ przyczyny tej niesposób zlikwidować, zatem proces korozji jest zjawiskiem nieuchronnym. Na skutek korozji, ok. 1/3 produkcji światowej stali, przeznaczona jest wyłącznie na usuwanie strat korozyjnych. Coraz większy jest udział produkcji wysokogatunkowych stali, o zwiększonej odporności na korozję. Na ochronę antykorozyjną przeznaczane są ogromne środki finansowe.
Zaproponowałem wyżej niezmiernie widowiskowy sposób przedstawienia uważanego za jednego z najmniej atrakcyjnych, ale jednocześnie bardzo istotnego praktycznie chemicznego, problemu życia codziennego. Jedne z piękniejszych doświadczeń... Zarówno ze względu na wyjątkowo przejrzysty efekt dydaktyczny (dobitna ilustracja skomplikowanego procesu elektrochemicznego), jak i wrażenia estetyczne. Aż dziw, że tak piękne doświadczenia nie znalazły się w propozycji szkolnej, a również w programach akademickich. Nauczanie chemii w szkole i na wyższej uczelni jedynie kredą po tablicy - to mieszanina zwykłego lenistwa z sabotażem dydaktycznym!
Tomasz Pluciński
nowy adres:
tomasz.plucinski@ug.edu.pl
| F | strona główna |