LUMINOL # [hydrazyd kwasu 3-aminoftalowego; 3-aminophtalhydrazide; (5-amino-2,3-dihydro-1,4-phtalazinedion)]
# nie mylić z lekiem - Luminalem
**ostatnia aktualizacja: 3.04.2019**
jest jedną z bardziej F efektownych substancji, dlatego zapewne otrzymuję sporo pytań o szczegóły syntezy. Jego synteza w warunkach laboratorium studenckiego jest nieskomplikowana, daje poza tym niebagatelną cechę osobistego zaangażowania emocjonalnego w wynik pracy, pozwala wreszcie na znaczną oszczędność (katalog odczynników Aldrich: ok. 47 Euro za 5 g, niektóre giełdy odczynników oferują go w cenie ok. 30 zł za 1 g).
Studenci; domagajcie się u P.T. prowadzących zajęcia, aby na ćwiczeniach laboratoryjnych dawano Wam coś atrakcyjnego do pracy, a nie np. ftaliloglicynę lub "bromooctan" glukozy...
Na marginesie jego niecodziennych właściwości, w jednym z opisów zwrócono uwagę, że zadziwiający jest gwałtowny ubytek substancji w jednym z ostatnich etapów syntezy studenckiej: przy ważeniu uzyskanego ostatecznego produktu. Podczas tej nieskomplikowanej czynności obserwuje się ubytki sięgające aż 50%! Istnieją uzasadnione podejrzenia, że to niecodzienne zjawisko pozostaje raczej w jakimś związku z atrakcyjnością substancji, niż z jej lotnością...
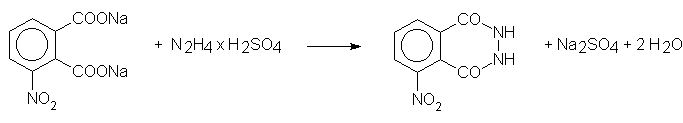
Synteza luminolu polega na kondensacji kwasu 3-nitroftalowego (lub bezwodnika tego kwasu, lub jego soli), z hydrazyną (bezwodną lub z solą hydrazyny), w podwyższonej temperaturze.
Najwygodniejsze jest użycie soli sodowej kwasu 3-nitroftalowego oraz soli hydrazyny (bezwodna hydrazyna jest bardzo kosztowna i niebezpieczna). Kwas 3-nitroftalowy otrzymuje się przez nitrowanie bezwodnika ftalowego. Niestety, konieczne jest późniejsze kłopotliwe wyodrębnienie właściwego izomeru. Po szczegóły odsyłam do podręczników preparatyki organicznej. Można także użyć bezwodnika 3-nitroftalowego, który stosowany jest rutynowo na studenckich ćwiczeniach z preparatyki organicznej, jako odczynnik do identyfikacji alkoholi.

Kondensację prowadzi się w temperaturze 160-170 °C. Zwracam uwagę, że typowym błędem jest mierzenie temperatury łaźni ogrzewającej (np. piaskowej); pamiętać należy, że temperatura wewnątrz naczynia może być nawet o kilkadziesiąt stopni niższa... Wygodnym rozwiązaniem może być użycie suszarki laboratoryjnej z regulowaną temperaturą. Pamiętać jednak trzeba o tym, że podczas kondensacji wydzielają się pewne ilości lotnych substancji (część kwasu 3-nitroftalowego sublimuje). Naczynie reakcyjne trzeba więc zaopatrzyć w długą rurkę odprowadzającą opary poza laboratorium. Rurka powinna mieć odpowiednio dużą średnicę, aby resublimujące substancje nie spowodowały jej zatkania. Z oczywistych powodów nie można użyć ani gumy, ani plastiku. Kłopotliwe jest rozwiązanie uszczelnienia drzwiczek. W warunkach domowych idealne byłoby użycie kuchennego piekarnika. Opisane problemy należałoby tu jednak rozwiązać szczególnie starannie - z powodu toksyczności ew. sublimujących substancji!
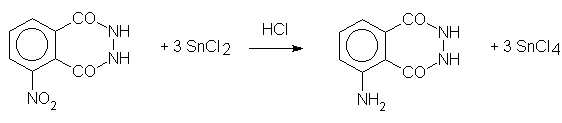
Drugi etap polega na redukcji otrzymanej nitropochodnej - do aminopochodnej. Proponowane jest tu najczęściej użycie soli cynawej, lub roztworu wielosiarczku. Sól cynawa jest co prawda droższa, ale synteza jest znacznie prostsza, gdyż odpada kłopotliwe i niebezpieczne sporządzanie siarczku z gazowego H2S. Można również do redukcji użyć podsiarczynu sodu Na2S2O4. Jeszcze elegantszym rozwiązaniem byłoby opracowanie warunków redukcji elektrolitycznej. Redukcja amalgamowanymi metalami stwarza sporo kłopotów.
Jeśli luminol ma być użyty do demonstracji chemiluminescencji, to doskonale nadaje się do tego w postaci surowej, nieoczyszczonej; oczyszczanie związane jest bowiem ze znacznymi stratami.
Rozpuszczalność luminolu w roztworach zasad wynika z kwasowego charakteru ugrupowania hydrazydowego w sąsiedztwie dwu grup karbonylowych. Natomiast obecność grupy aminowej nadaje mu charakter zasadowy (istnieje chlorowodorek luminolu).
Poniższe przepisy pochodzą z prac, które zamieszczam na końcu opracowania. Poniższy przepis jest znacznie uproszczony w stosunku do tego, który umieszczony jest w pierwszej pozycji literaturowej (posiadacze tej książeczki proszeni są o dokonanie odpowiednich zmian. Przy okazji: warto dokonać F erraty ...).
Hydrazyd kwasu 3-nitroftalowego
42 g (0,2 mola) kwasu 3-nitroftalowego (lub 38,6 g bezwodnika) w 500 ml wody zobojętnić powoli 6 M roztworem NaOH w obecności fenoloftaleiny. Ewentualne różowe zabarwienie usunąć niewielkim dodatkiem kwasu 3-nitroftalowego. Do otrzymanego roztworu soli sodowej dodać 26 g (0,2 mola) siarczanu hydrazyny N2H4 • H2SO4 i mieszaninę odparować ostrożnie do sucha pod wyciągiem. Ochłodzoną masę rozetrzeć w moździerzu i ogrzewać w zamkniętym naczyniu zaopatrzonym w niezbyt wąską rurkę odprowadzającą ew. gazy, przez 3 godz. w temp. 160-170°C na łaźni olejowej (olej może silnie dymić, wtedy użyć raczej łaźni piaskowej) lub w suszarce (ma to być temperatura wnętrza naczynia, a nie łaźni). Spieczoną masę wydobyć z naczynia (może być konieczne rozbicie naczynia), sproszkować w moździerzu, zalać niewielką ilością zimnej wody. Następnie przenieść ją na sączek, powtórzyć ługowanie siarczanu sodu wodą jeszcze dwukrotnie, przemyć eterem i suszyć surowy hydrazyd kwasu 3-nitroftalowego.
Hydrazyd kwasu 3-aminoftalowego (luminol)
redukcja solą cynawą
Do roztworu 45 g
SnCl2 • 2H2O w
225 ml ciepłego stężonego kwasu solnego dodawać powoli porcjami, ogrzany do
50°C, roztwór 10 g hydrazydu kwasu 3-nitroftalowego w 100 ml 5-procentowego
roztworu NaOH, utrzymując cały czas temperaturę 50-60°C. Po dłuższym chłodzeniu
w lodówce (oziębieniu do temp. 0°C), krystalizuje surowy żółtawy
chlorowodorek hydrazydu kwasu 3-aminoftalowego. Osad odsączyć, przemyć
niewielką ilością zimnej wody i suszyć (uwaga: podczas suszenia uwalniają
się resztki oparów chlorowodoru). Wydajność sięga 60-70% wydajności
teoretycznej. Jeśli konieczne jest uwolnienie produktu od soli cyny,
można surowy produkt rozpuścić w niewielkiej ilości DMSO i przesączyć,
albo rozpuścić go w 10-procentowym wodnym roztworze amoniaku i przesączyć.
Przesącz zakwasić rozcieńczonym kwasem octowym i otrzymany osad odsączyć
(lub po prostu do pokazu stosować alkaliczny roztwór luminolu).
Oczyszczanie luminolu przeznaczonego do demonstracji chemiluminescencji jest zbędne.
redukcja solą cyny uchodziła za najwygodniejszą, przede wszystkim z powodu dogodnej do sączenia konsystencji produktu. Nieco niżej opisuję jeszcze bardziej obiecującą metodę
redukcja
wielosiarczkiem
21 g siarczku amonowego rozpuszcza się w 40 ml wody i dodaje się
porcjami, mieszając i chłodząc w lodzie, 10 g surowego hydrazydu
3-nitroftalowego. Po dodaniu ogrzewa się mieszaninę do wrzenia przez godzinę,
przepuszczając przez nią powolny strumień siarkowodoru. Roztwór oziębia
się silnie i odsącza żółty osad luminolu, zawierający nieco
elementarnej siarki. Większą ilość produktu można otrzymać zakwaszając
przesącz lodowatym kwasem octowym. W celu oczyszczenia produkt rozpuszcza się
w 5 %-owym roztworze wodorotlenku sodowego (należy zwrócić uwagę na
wykorzystywaną w ten sposób kwasowość iminowych atomów wodoru), odsącza się
siarkę i wytrąca z przesączu luminol przez zakwaszenie lodowatym kwasem
octowym. Wydajność 6,5 g (75%).
[przepis
zaczerpnięty z drugiej pozycji literatury]
redukcja
podsiarczynem
5 g surowego hydrazydu 3-nitroftalowego rozpuścić
w 30 ml 3 M roztworu NaOH i dodawać niewielkimi porcjami 15 g podsiarczynu sodu
Na2S2O4.
Redukcji towarzyszy silne rozgrzanie brunatnego roztworu oraz rozjaśnienie
barwy. Po dodaniu całej ilości podsiarczynu odczekać, aż zakończy się
egzotermiczny etap reakcji, i kolbę ogrzać krótko do wrzenia. Po ostygnięciu
odsączyć niewielkie ilości stałych zanieczyszczeń, a przesącz zakwasić
kwasem octowym. Unikać nadmiaru kwasu, bo powstały ubocznie tiosiarczan rozkłada
się z wydzieleniem siarki oraz cuchnącego dwutlenku siarki; powstają również
pewne ilości siarkowodoru (wyciąg). Po ochłodzeniu w lodówce bezpostaciowy
osad luminolu odsączyć na lejku Schotta.
** Czas niesie postęp w chemicznych procedurach (niżej zamieszczam zmodyfikowane procedury)...
Spiekanie suchej mieszaniny nitroftalanu sodu z solą hydrazyny jest niewygodne z powodu iluzorycznej kontroli temperatury; użycie kuchenki mikrofalowej także nie jest optymalne. Glikol trójmetylenowy jako medium grzejne dodane do mieszaniny, jest kosztowny i trudno dostępny. W zastępstwie proponuję użycie bezwodnej gliceryny, glikolu lub wręcz płynu hamulcowego zawierającego glikol. Reakcję prowadzić w temperaturze 215-220 stopni przez kilka minut, w przypadku glikolu maksymalna możliwa temperatura to ok. 215 stopni; reakcję najwygodniej prowadzić w aluminiowej puszce np. po piwie. Spiek soli powinien być przedtem bardzo dokładnie sproszkowany i wysuszony aby zmniejszyć pienienie. Reakcję prowadzić pod wyciągiem, bo sublimujące resztki kwasu nitroftalowego oraz opary hydrazyny i glikolu są toksyczne. Po zakończeniu ogrzewania brudnożółty hydrazyd nitroftalowy ługować kilkakrotnie wodą (Na2SO4), odsączyć i przemyć wodą. Po wysuszeniu dokładnie sproszkować.
Do redukcji ugrupowania nitrowego proponowana jest zupełnie nowatorska nadzwyczaj wygodna laboratoryjnie metoda z użyciem niezwykłego odczynnika - dwutlenku tiomocznika TUD. Otrzymuje się go w reakcji tiomocznika z perhydrolem. Niezwykłość polega na tym, że TUD będący produktem niewątpliwego procesu utleniania, ma energiczne właściwości redukujące! Jest to produkt handlowy, stosowany np. do redukcyjnego wybielania masy papierowej i tkanin.
Dwutlenek tiomocznika (TUD, produkt utlenienia będący energicznym reduktorem)Do 15 g 30-procentowego H2O2 (perhydrolu) w aluminiowej puszce po napojach ze spłaszczonym denkiem umieszczonej w większym naczyniu z mieszaniną chłodzącą (lód z solą), ze sprawnym mieszadłem magnetycznym - dodawać ostrożnie małymi porcjami 5 g tiomocznika (TU), utrzymując temperaturę poniżej 20 stopni. Po dodaniu ok. 1/3 tiomocznika zaczyna wytrącać się biały osad. Po dodaniu całości kontynuować mieszanie przez 15 min, odsączyć na lejku, osad przemyć kilkoma ml zimnej wody, suszyć. Wydajność 5,1 g (73% teoretycznej).
https://www.bitchute.com/video/6DY4AjFTer4v/
Zalecana jest ostrożność: tiomocznik reaguje z perhydrolem w temperaturze pokojowej w sposób gwałtowny, prawie wybuchowy.
Redukcja nitroftalohydrazydu dwutlenkiem tiomocznika.
W kolbie z mieszadłem magnetycznym umieścić 6,67 g nitroftalohydrazydu który rozpuścić w 74 ml 4,5 M roztworu amoniaku (22,7 g czyli 25 ml 25-procentowej wody amoniakalnej + 50 ml wody). Do brązowego roztworu dodawać małymi porcjami 13,94 g DTU; reakcja jest egzotermiczna, roztwór ulega rozjaśnieniu. Po dodaniu całości ogrzewać przy 90 stopniach w ciągu 30 minut. Opary amoniaku usuwać rurką w obręb wyciągu. Mieszaninę ochłodzić i zneutralizować 21,28 g lodowatego kwasu octowego, wytrącony bezpostaciowy osad sączyć na lejku Buchnera pod zmniejszonym ciśnieniem. Użycie kwasu solnego i pozostawienie brei na 12 godzin daje produkt o konsystencji łatwiejszej do sączenia; należy kontrolować papierkiem wskaźnikowym odczyn (do lekko kwasowego). Wydajność 3,76 g Luminolu, przesącz zawiera czterotionian lub tiosiarczan, i po zakwaszeniu wydziela silny zapach SO2.
https://www.youtube.com/watch?v=-PGtoZEZnzc
https://www.youtube.com/watch?v=u0GhnbEoSKE spiekanie z gliceryną
https://www.youtube.com/watch?v=58Ve69s0qD0 redukcja z Al
LITERATURA
T.Pluciński. "Doświadczenia
chemiczne" . Wyd. “Adamantan”, Warszawa 1997,
s. 21. [Luminol: synteza i reakcje z luminolem]
N.S.Isaacs. "Fizyczna chemia organiczna. Ćwiczenia.",
PWN, Warszawa 1974, s. 237 [synteza; redukcja wielosiarczkiem]
A.Arendt, A.M.Kołodziejczyk, T.Sokołowska. "Ćwiczenia
laboratoryjne z chemii organicznej", Wyd. Politechniki Gdańskiej, Gdańsk
1980, ss. 80 i 15. [synteza]
Kurier Chemiczny nr. 3 (1991), s. 16 [opisy
syntezy]
J.Chem.Educ., 11, 241 (1934) [opis syntezy
Huntressa i in.]
J.Chem.Educ., 47, 519 (1970) [przegląd
reakcji z Luminolem]
J.Chem.Educ., 44, 396 (1967) [reakcje
chemiluminescencji w roztworach (przegląd)]
Tomasz Pluciński
nowy adres:
tomasz.plucinski@ug.edu.pl
| F | strona główna |